主な研究内容
1. 白血病におけるBCR-ABLやMLL-AF4キメラ遺伝子の病態解析
フィラデルフィア(Ph)染色体によって構成されるbcr-ablは、慢性骨髄性白血病(CML)の原因遺伝子であることが証明されています。しかし何種類もあるabl融合遺伝子陽性白血病に関しては未だその造白血病分子機構の詳細は明らかとなったとは言えません。我々はP210bcr/abl亜型のP230bcr/ablによるTgマウスを作成し病態解析を行うとともに、急性リンパ性白血病(ALL)に新たに発見されたRCSD1-abl cDNAのクローニングに成功し、in vitroおよび遺伝子導入マウス作成、in vitroにてその病態解析を行っています。またMLL-AF4陽性ALLは予後不良とされていますが、その分子メカニズムは不明な点が多く残されています。そこで我々はMLL-AF4のin vitroや、in vivoでの機能解析を行い、たとえばIL24を搭載したアデノ随伴ウイルス8型AAV8ベクター(AAV8-IL24)を作成しMLL/AF4陽性ALLへの遺伝子治療の研究などを行っています。
2. 骨髄不全症におけるテロメア関連遺伝子異常に関して
先天性角化不全症(DKC)は網状色素沈着、爪の萎縮、舌の粘膜白斑症などといった特徴的身体的所見を伴う先天性の骨髄不全症(BMF)です。DKCの約60%の症例において原因遺伝子が同定され、テロメラーゼ複合体を構成する遺伝子群である、DKC1、telomerase RNA component、telomerase reverse transcriptaseなどに変異が認められています。テロメラーゼ複合体は細胞分裂によるテロメアの短縮化に対しテロメアの複製、安定の役割をもち、DKCはこれらの遺伝子の変異によりテロメアが短縮化し、その結果造血幹細胞などの増殖能に障害が起き上記の症候が形成されると考えられています。
我々はDKCの原因遺伝子である上述のテロメア制御遺伝子の変異が、一部の再生不良性貧血(AA)や骨髄異形成症候群(MDS)に認められ、特徴的身体所見を伴わず緩徐に発症する不全型DKCの存在が明らかにしました。不全型DKCは、臨床的にAAやMDSと診断されることがあり、BMFの臨床診断において鑑別することは重要です。現在我々はBMFにおけるDKCおよび不全型DKCのスクリーニング法としてテロメア長測定の意義や、次世代シークエンサーを用いてDKCの新規原因遺伝子の探索などを研究しています。またテロメア長測定に関しては随時ご相談になります。研究責任者の山口博樹(y-hiroki@fd6.so-net.ne.jp)までご連絡いただければ幸いです。
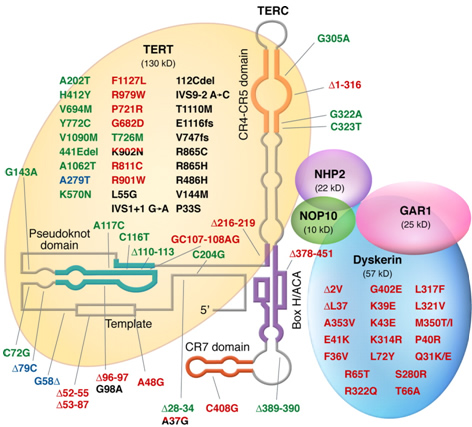
緑:BMFで認められた変異、赤:DKCで認められた変異、黒:肺線維症で認められた変異、青:遺伝子多型 文献8より改変
3. 急性骨髄性白血病、骨髄増殖性腫瘍における遺伝子異常に関して
Flt3ITDなどの遺伝子変異検索は、急性骨髄性白血病(AML)の臨床的予後を決定するのに重要と考えられています。我々はAMLの遺伝子変異(Flt3ITD、NPM1、CEBPA、c-kit、DNMT3A、TET2、IDH1/2など)の臨床的特徴や予後との相関を明らかにすることを目標に研究をおこなっています。特に高感度のc-kit遺伝子変異検索法を開発し、従来のc-kit変異解析では検出されなかった微小なc-kit変異陽性白血病クローンが初発時より存在し、再発時に増加することを明らかにしました。
さらにAML初発時再発時ペアー検体に関して遺伝子変異を網羅的に解析したところ、DNMT3Aなどのエピジェネティクス制御遺伝子変異は初発再発を通して変異が消失することはなく微小残存病変マーカーとして有用であること、さらに初発時にエピジェネティクス制御遺伝子変異を認めると再発時に高率に予後不良のFlt3ITDが付加されることなどを明らかにしました。
最近では次世代シークエンサーを用いて遺伝子変異の網羅的検索を行ったところ、遺伝子変異を3つ以上有するcomplex genetic abnormality(CGA)を認める症例は有意に予後不良であることや(図2)、DNMT3A、TET2、IDH1/2といったメチル化制御遺伝子変異のいずれかに変異を認めると予後不良であることを明らかにした。
図2
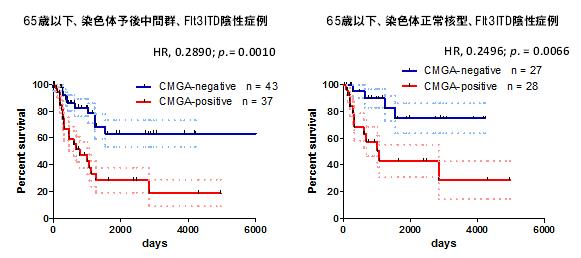
文献14より改変
また真性多血症や本態性血小板血症といった骨髄増殖性腫瘍(MPN)におけるJAK2、MPL、CALR遺伝子変異解析を行い、本邦におけるこれらの遺伝子変異を有するMPNの臨床的特徴を研究しています。そして既知の遺伝子変異が認められない症例に関して、新規の遺伝子変異の探索を行っています。AMLやMPNの遺伝子変異検索の依頼は随時受け付けています。研究責任者の山口博樹(y-hiroki@fd6.so-net.ne.jp)までご連絡いただければ幸いです。
4. 多発性骨髄腫の病態解析
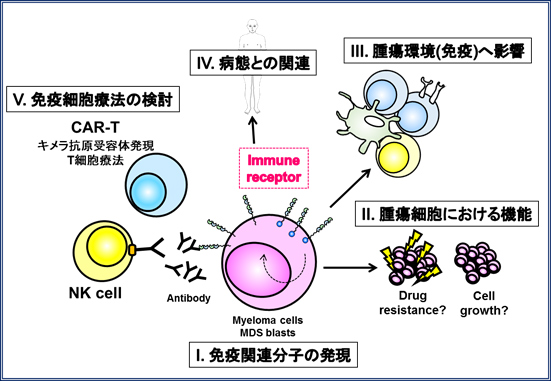
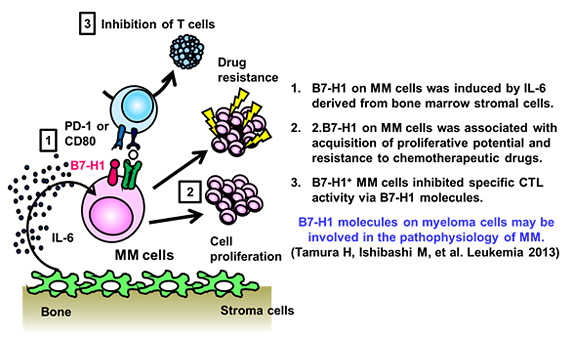
(1)骨髄腫細胞は骨髄環境内で接着分子を介してストローマ細胞に接着、サイトカインからのシグナルを受けて、生存、増殖し、さらには薬剤耐性を獲得しています。我々は、骨髄腫細胞が正常形質細胞と異なり、補助シグナル分子B7 family分子を発現していること、これら分子が腫瘍の増殖に関与していることなどを報告してきました。特に免疫チェックポイント分子PD-1に作用するB7-H1(PD-L1、CD274)分子が、患者骨髄腫細胞において発現誘導され、腫瘍増殖や薬剤耐性の誘導、病勢の進行に関与していることを見出しました。これらの研究により、新たな視点からの骨髄腫の病態解明、そして免疫療法の開発を目指しています。これらの研究により、新たな視点からの骨髄腫の病態解明、そして免疫療法の開発を目指しています。
(2)関東、東北の大学病院とその関連施設(現在5大学10施設)と共同研究を行っており、多発性骨髄腫患者における、腫瘍増殖、予後や薬剤耐性に関与するサイトカイン等のバイオマーカーや細胞表面抗原、遺伝子発現について解析し、病態解析とそれらを標的とした新規治療法の開発について研究しております。特に患者骨髄腫細胞に比較的特異的に発現する抗原を見いだし、それに対する抗体治療やキメラ抗原受容体を用いた遺伝子改変T(CAR-T)細胞療法の開発を目指しています。
5. 骨髄異形成症候群(MDS)の免疫診断と病態解析、免疫治療の開発
MDSは主に骨髄系幹細胞の異常クローンが増殖、分化し、20-40%が急性骨髄性白血病に進行する疾患ですが、種々の免疫異常も報告されており、病気の進行と関与している可能性が考えられます。我々は、MDS患者における、(1)NK細胞やT細胞の数的、機能的異常、サイトカイン産生異常などの免疫病態、(2)MDS芽球の発現する細胞表面抗原、などを解析し、それらと腫瘍の細胞周期や増殖、病態、臨床的特徴などとの関連について検討し、病気進行のメカニズム、さらには免疫治療の可能性について研究しています。また、WT1などのMDS腫瘍抗原の同定および発現解析を行い、MDSに対する腫瘍ワクチンの可能性についても研究しています。さらに、T細胞免疫の回復や制御性T細胞の抑制、および腫瘍ワクチンなどの併用により、移植非適応患者に対する新規治療法の開発を目指しています。
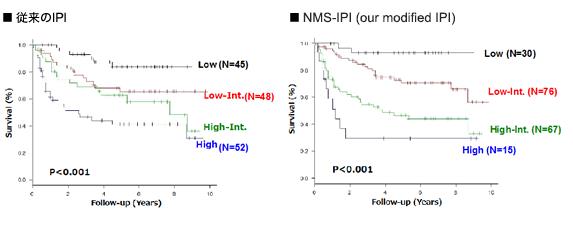
6. 悪性リンパ腫への進展メカニズムと予後予測システムの開発
特殊なリンパ腫、特に甲状腺原発リンパ腫などの症例を集積し、その臨床的特徴や病態を解析し、橋本病からリンパ腫への進展メカニズムなどについて研究しています。
また、びまん性大細胞型B細胞リンパ腫症例の予後因子について解析し、新規予後予測システムNMS-IPIを提唱するとともに、さらなる予後予測システムの開発と新規バイオマーカーの研究を行っています。