倫理審査申請について
新規申請における倫理委員会選択フロー
中央倫理委員会と各付属病院倫理委員会の対象となる研究は、図1でご確認ください。
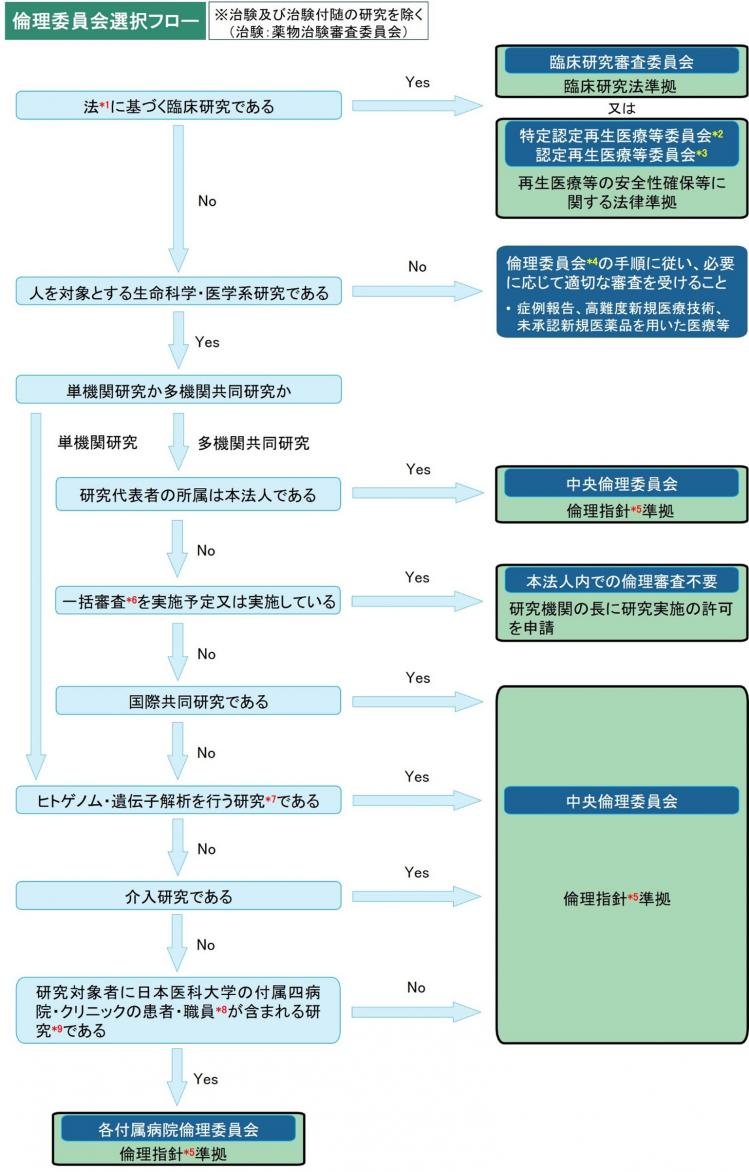
*1:臨床研究法及び再生医療等の安全性の確保等に関する法律
*2:第1種・第2種再生医療等
*3:第3種再生医療等
*4:本法人の研究責任者(多機関共同研究の場合、研究代表者、以下同様)からの審査希望の場合は、研究責任者の所属施設が設置する倫理委員会、本法人以外の研究責任者からの審査希望の場合は中央倫理委員会における審査になります。なお、当該倫理委員会事務局へ理由書(任意書式)を提出してください。
*5:人を対象とする生命科学・医学系研究に関する倫理指針
*6:一括審査結果が受け入れ可能な研究機関 の倫理委員会でない場合は、本法人の倫理委員会の審査が必要になります。
*7:体細胞系・生殖細胞系にかかわらず全てのヒトゲノム・遺伝子解析研究は中央倫理委員会における審査になります。
*8:臨床研究の委託/外注スタッフ等も含まれます。
*9:日本医科大学の付属四病院・クリニックの患者・職員が参画しているレジストリを活用した研究も含まれます。
中央倫理委員会 様式
様式1 一括審査対象の共同研究機関リスト (Word:19KB)
様式2 研究機関要件確認書 (Word:23KB)
様式3 研究に係る利益相反状況申告書 (Word:49KB)
(記載例などは「利益相反に関する様式(学内専用)」を参照してください。)
様式4 研究者リスト (Word:30KB)
様式5-1 他の研究機関への試料・情報の提供に関する(申請・報告)書 (Word:29KB)
様式5-2 他の研究機関への試料・情報の提供に関する記録 (Word:23KB)
様式5-3 日本国外にある研究機関への試料・情報の提供に関する(申請・報告)書 (Word:27KB)
様式6-1 研究計画書(介入) (Word:98KB)
様式6-2 研究計画書(観察) (Word:76KB)
様式7 説明同意文書 (Word:42KB)
様式8-1 情報公開文書(単機関用) (Word:26KB)
様式8-2 情報公開文書(多機関用) (Word:30KB)
様式9 宣誓書 (Word:20KB)
様式10‐1 確認書(部署長) (Word:22KB)
様式10‐2 確認書(大学院教授) (Word:24KB)
研究開始までの流れ
<新規で研究を実施する場合>(1)多機関・介入研究(研究代表者が本法人)、単機関・介入研究又は多機関・観察研究(研究代表者が本法人)、本法人の
中央倫理委員会に倫理審査を申請してください。
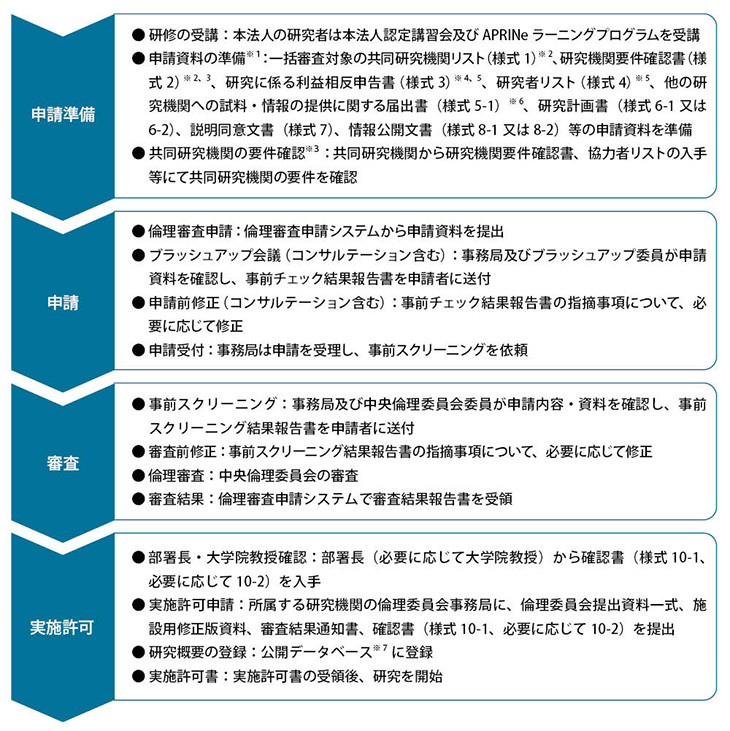
| 研究機関の区分 | 研究代表者が共同研究機関に求める資料 |
| 研究代表者が所属する機関 | 様式1、3、5‐1、(9) |
| 本法人の共同研究機関 | 様式3 |
| 本法人以外の共同研究機関 | 様式2、4 |
※4 本法人の研究者は本学の利益相反マネジメント委員会の規定に従います。


所属する研究機関の倫理委員会に倫理審査を申請してください。

※1 本法人の研究者は本学の利益相反マネジメント委員会の規定に従います。
(4)試料・情報の提供のみを行う者(共同研究機関に所属しない)の場合
倫理審査の申請は不要です。

※1 試料・情報の提供に伴い、オプトアウト等を使用する場合には、使用見本(施設版)を提出してください。
※2 試料・情報を他の研究機関に提供する際には、他の研究機関への試料・情報の提供に関する記録(様式5‐2)を提供先に
提出してください。
提供する試料・情報の分類
| 分類 |
定義 (人を対象とする生命科学・医学系研究に関する倫理指針より) |
|
新たに試料・情報を取得し、研究機関に 提供のみを行う者 |
研究対象者から新たに試料・情報を取得し(侵襲(軽微な侵襲を除く。)を伴う試料の取得は除く。)、研究機関に提供のみを行う機関は、「研究協力機関」に該当します。 軽微な侵襲を上回る侵襲を伴う新規試料の取得を行う際には、「共同研究機関」となることが想定されます。他方、軽微な侵襲のみを伴う又は侵襲を伴わない新規試料・情報の取得をし、他の研究機関に提供のみを行う場合であっても、共同研究機関となることは問題ありません。 |
| 既存試料・情報の提供のみを行う者 |
既存試料・情報の提供以外に研究に関与しない者を指し、例えば、医療機関に所属する医師等が当該医療機関で保有している診療情報の一部について、又は保健所等に所属する者が当該保健所等で保有している住民の健康に関する情報の一部について、当該情報を用いて研究を実施しようとする研究者等からの依頼を受けて提供のみを行う場合などが該当します。 既存の試料・情報の提供のみを行う場合には、「研究協力機関」、「試料・情報の収集・提供を行う機関」のいずれにも該当せず、「既存試料・情報の提供のみを行う者(あるいは機関)」となります。既存の試料・情報の提供のみを行う機関は、必ずしも共同研究機関となることを要しませんが、共同研究機関となることは問題ありません。 |
試料・情報を他の研究機関へ提供する場合、提供を受ける場合の資料について
| 提供の有無 | 提供する | 提供を受ける | ||
| 新規・既存 | 新規 | 既存 | 新規 | 既存 |
| 倫理審査申請※1、2 | 様式5‐1(雛形) | 様式5‐1(雛形) | ||
| 様式7(雛形) | 様式7、8(雛形) | 様式7(雛形) | 様式7、8(雛形) | |
| 提供の許可申請※2 | 様式5‐1(施設版) | 不要 | ||
| 様式7(施設版) | 様式7、8(施設版) | 不要 | ||
| 試料・情報授受 | 様式5‐2(交付) | 様式5‐2(受領) | ||
| 保管期間 | 3年※3 | 5年※4 | ||
※1 本法人倫理委員会で審査する場合
※2 詳細は、人を対象とする生命科学・医学系研究に関する倫理指針ガイダンス<参考>既存試料・情報の授受における提供
元の機関と提供先の機関のインフォームド・コンセント等の手続の関係性を確認してください。
※3 情報提供を行った日から3年
※4 終了報告から5年
旧指針から継続(実施中)する研究の審査について
| 一括審査を希望しない場合 | 一括審査を希望する場合(代表機関) |
| 変更申請先:所属の病院・大学倫理委員会(従前の倫理委員会) | 変更申請先:研究代表者が所属する倫理委員会 |
実施中の研究の一括審査を希望する場合の手順について
(1)研究代表者が本法人の場合
研究代表者が所属する研究機関の倫理委員会に変更申請を行います。

※1 本法人以外の研究機関に所属する研究者について提出が必要になります。
※2 付属四病院・大学は不要です。他機関については研究機関要件確認書(様式2)又は宣誓書(様式9)の提出が必要になり
ます。
※3 本法人以外の研究機関における利益相反申告状況、教育・研修は当該研究機関の規定に従います。
※4 本法人の研究者は本学の利益相反マネジメント委員会の規定に従います。
(2)研究代表者が他機関の場合

※1 研究計画において、オプトアウト等を使用する場合には、当該機関で使用見本(施設版)を提出してください。
多機関共同研究の一括審査の提出資料
一括審査で提出する資料
| 資料 | 様式 |
| 研究代表機関が作成し提出する資料 | 様式1、3、5‐1、(9) |
| 本法人の共同研究機関の研究責任医師が作成する資料 | 様式3 |
| 本法人以外の共同研究機関の研究責任医師が作成する資料 | 様式2、4 |
その他申請に関する質問について
申請に関する質問事項をリストにして紹介しています。
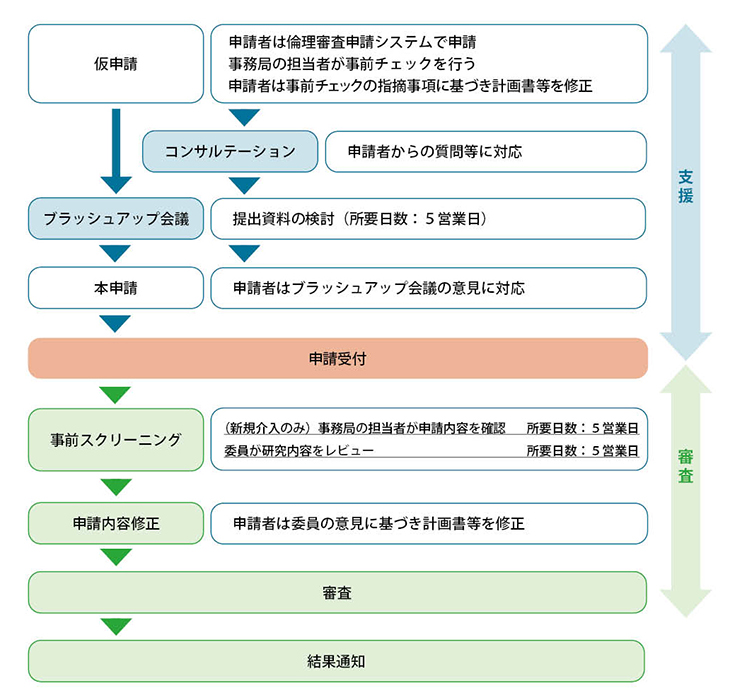
中央倫理委員会の支援・審査について
図2 中央倫理委員会申請の支援・審査フロー
中央倫理委員会 開催日程及び申請受付締切日
| 委員会開催日 |
申請申し込み締切日 |
| 2024年4月1日(月) | 2024年2月19日(月) |
| 5月13日(月) | 3月25日(月) |
| 6月3日(月) | 4月15日(月) |
| 7月1日(月) | 5月20日(月) |
| 8月5日(月) | 6月24日(月) |
| 9月2日(月) | 7月22日(月) |
| 10月7日(月) | 8月26日(月) |
| 11月11日(月) | 9月30日(月) |
| 12月2日(月) | 10月21日(月) |
| 2025年1月6日(月) | 11月18日(月) |
| 2月3日(月) | 12月16日(月) |
| 3月3日(月) | 2025年1月20日(月) |
研究に係る契約について
・共同研究を実施する場合:共同研究申込書と共同研究契約書が必要になります。・外部企業等からの受託研究を受ける場合:受託研究申込書と受託研究契約書が必要になります。
・外部企業等(個人を含む)に業務を委託する場合:業務委受託契約書が必要になります。
・企業等から研究資金の提供を受ける場合:資金提供に関する契約書が必要になります。
※契約書は審査対象資料ではありませんが、中央倫理委員会へ申請の際には、倫理申請システムにアップロードしてください。
契約に際しては、事前に契約内容の相談を受けてください。
付属病院:臨床研究総合センター / 武蔵小杉病院、多摩永山病院、千葉北総病院:事務部庶務課
関連サイト
「人を対象とする生命科学・医学系研究に関する倫理指針」は文部科学省又は厚生労働省のホームページでご確認ください。中央倫理委員会事務局 問い合わせ先
申請に関する問い合わせ
担当:牛谷(うしたに)E-mail:chuorinri.group@nms.ac.jp
倫理講習に関する問い合わせ
担当:大和久(おおわく)、大塚(おおつか)E-mail:c-ethics@nms.ac.jp
倫理審査申請システムのユーザー登録に関する問い合わせ
担当:大塚(おおつか)、島世(しませ)E-mail:ml_syst.csri.group@nms.ac.jp
-
学校法人日本医科大学
-
大学・専門学校
-
病院
-
クリニック
-
各種センター・研究所

